Antwort Was passiert bei der Kathode? Weitere Antworten – Was passiert an der Kathode
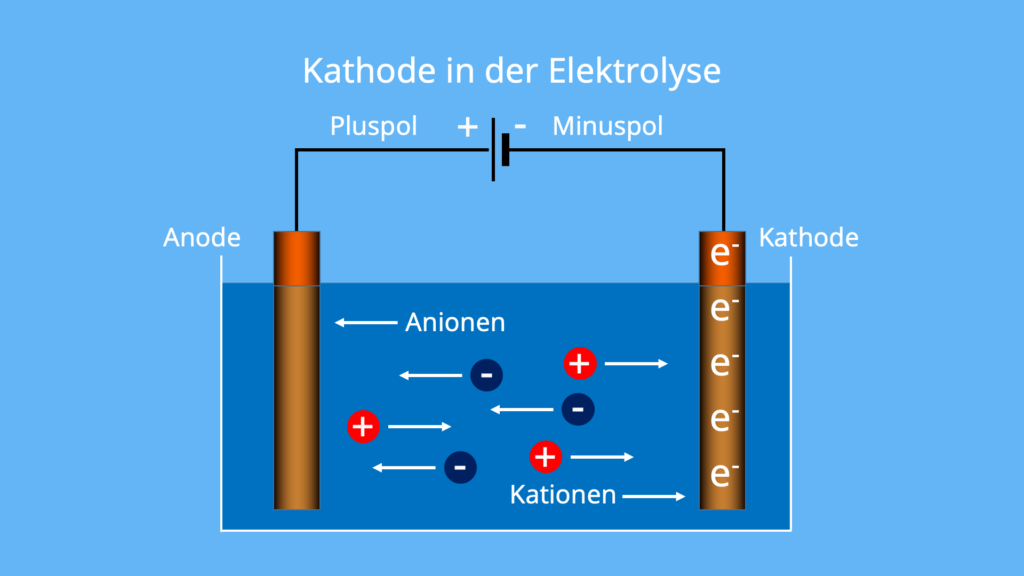
Die Oxidation ist die Reaktion der Anode auf die Abgabe von Elektronen aus der Anode. Daher ist die Anode negativ geladen. An der Kathode findet eine Reduktionsreaktion statt, bei der Elektronen von der Anode eingefangen (aufgenommen) werden. Daher ist die Anode elektronenarm und positiv geladen.Die Kathode ist dabei mit dem Minuspol verbunden und die Anode mit dem Pluspol. Bei der Elektrolyse wird Strom angelegt und daher elektrische Energie in chemische Energie umgewandelt. Durch das Anlegen eines Gleichstroms fließen die Elektronen von der Anode zur Kathode. Deshalb ist die Kathode negativ geladen.Die Kathode ist die Gegenelektrode zur Anode. Befinden sich Ionen oder freie Elektronen zwischen diesen Elektroden, wandern bei Stromdurchgang die Kationen zur Kathode, die Anionen zur Anode.
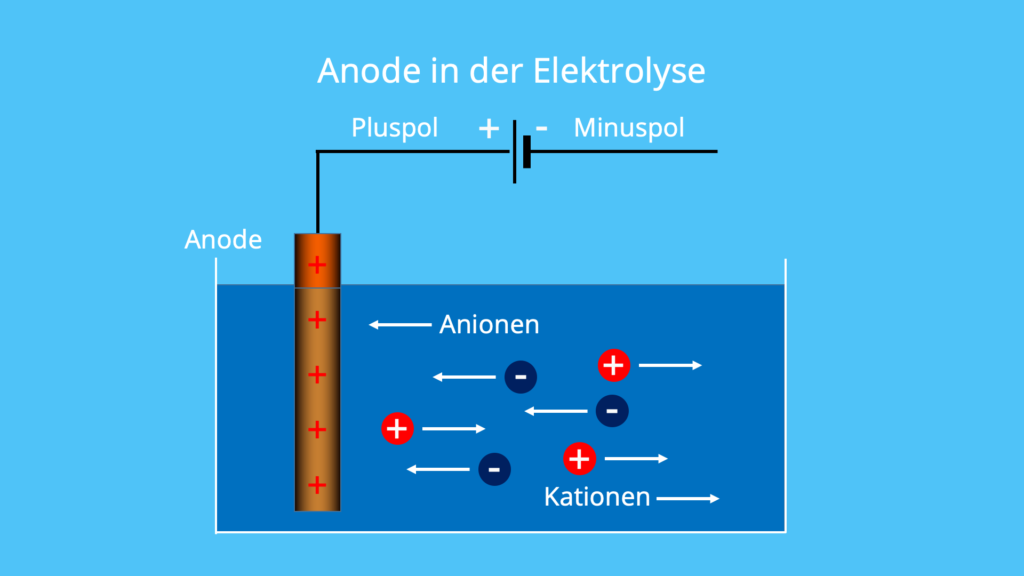
Wie unterscheidet man Anode und Kathode : Polarität. Für die elektrochemischen Elektroden gilt: Die Elektrode, an der die Oxidation abläuft, ist die Anode. Die Elektrode, an der die Reduktion abläuft, ist die Kathode.
Ist die Kathode positiv
Und da ist die Kathode wirklich der Minuspol. Dabei wird elektrische Energie in chemische Energie umgewandelt: Ein Stoff wird mit Hilfe von Strom zerlegt, zum Beispiel Wasser in H+-Ionen und OH–Ionen. Die H+-Ionen (Kationen) wandern natürlich zum Minuspol, OH- entlädt sich am Pluspol.
Wie erkennt man die Kathode : Das lange Beinchen ist immer + (Kathode) und der kürzere Anschluß ist – (Anode).
Eine Anode ist eine Elektrode, die Elektronen aufnehmen kann. Daher bezeichnest du die Anode auch als Elektronenakzeptor. Die ablaufende Reaktion bezeichnest du als Oxidation. Bei der Oxidation werden Elektronen abgegeben, die dann zu der Gegenelektrode, der Kathode fließen.
Eine Anode (von gr. ἄνοδος, anodos, "Weg nach oben") ist eine Elektrode, die – beispielsweise aus einem Vakuum oder Elektrolyt – Elektronen aufnimmt, an der also eine Oxidationsreaktion stattfindet. Sie ist die Gegenelektrode zur Kathode, welche Elektronen abgibt.
Was passiert an der Anode
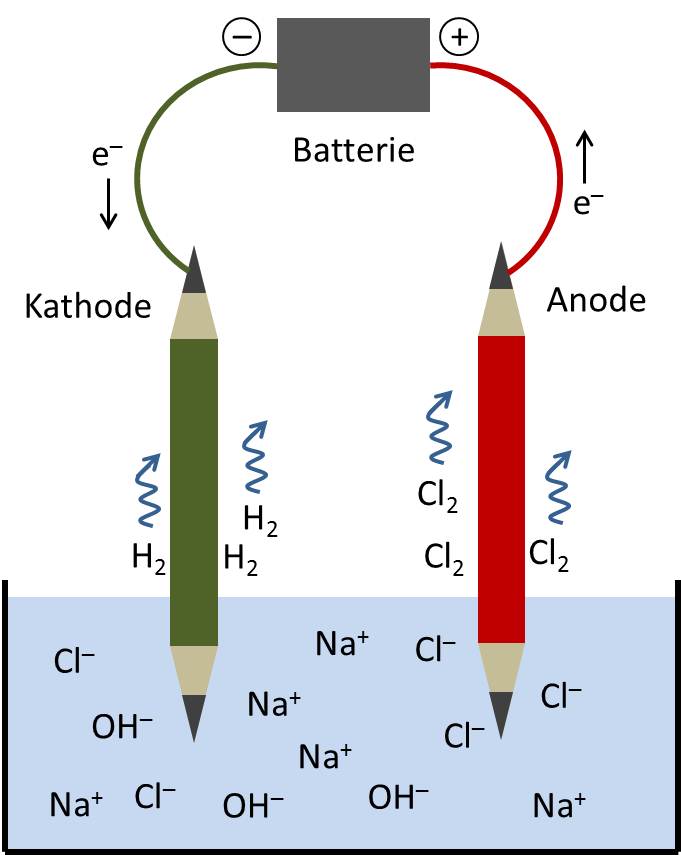
Eine Anode ist eine Elektrode, die Elektronen aufnehmen kann. Daher bezeichnest du die Anode auch als Elektronenakzeptor. Die ablaufende Reaktion bezeichnest du als Oxidation. Bei der Oxidation werden Elektronen abgegeben, die dann zu der Gegenelektrode, der Kathode fließen.Die Anode ist eine Elektrode, an der bei der Elektrolyse die Oxidation einer Redoxreaktion stattfinden kann. Im Gegensatz dazu findet an der Kathode die dazugehörige Reduktionsreaktion statt.An der Elektrode erfolgt der Übergang von elektrischen Ladungsträgern (Elektronen oder Ionen) vom Feststoff auf den Elektrolyten (Bild 1) oder umgekehrt. Der Ladungsträgerübergang ist in der Elektrochemie – anders als in der Physik – immer mit einem Stoffumsatz (Reduktion oder Oxidation) verbunden.
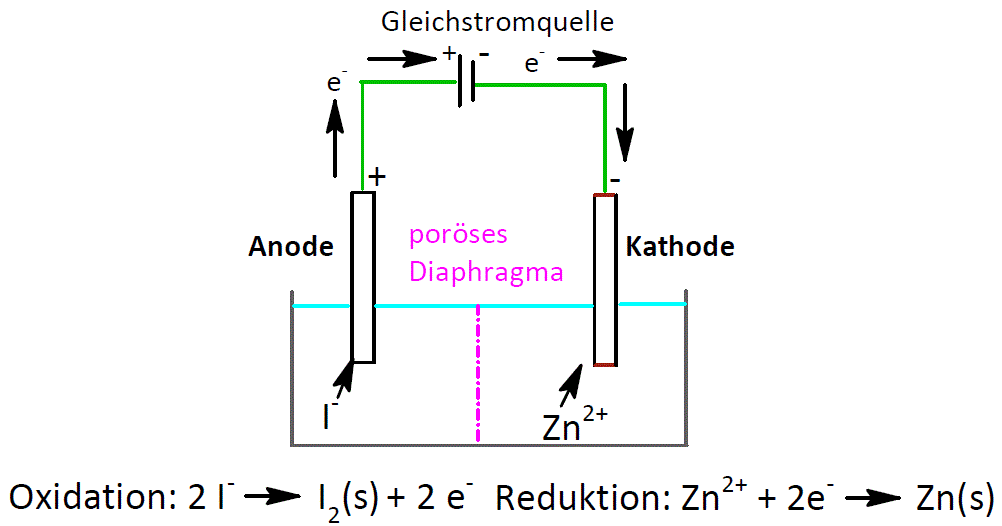
Als Anode wird die Elektrode bezeichnet, an der die Oxidation stattfindet. Die Katode ist die Elektrode an der die Reduktion erfolgt. Bei den freiwillig ablaufenden elektrochemischen Prozessen wird chemische Energie in elektrische Energie umgewandelt.
Was entsteht an der Anode : Somit entsteht an der Anode ein Elektronenmangel und an der Kathode ein Elektronenüberschuss. Der Elektronenüberschuss an der Kathode führt dazu, dass die positiven Kationen sich zur Kathode bewegen. Dort nehmen sie die überschüssigen Elektronen auf und werden somit reduziert.



